- STORIE
Accedi a MyEni

Fusione a confinamento magnetico: istruzioni per l’uso è un format originale di Eni con cui spieghiamo diversi aspetti legati a una tecnologia dall’enorme potenziale.
Come sappiamo, tutto quello che ci circonda, compresi noi stessi, è fatto di molecole. Le molecole sono composte da atomi legati fra di loro. E gli atomi a loro volta sono fatti di protoni e neutroni - che si trovano nei nuclei - e di elettroni - che si muovono attorno ai nuclei.
Il numero di protoni che si trova nel nucleo di un atomo ci dice di quale elemento stiamo parlando. L’Idrogeno ha un solo protone, l’Elio due, il Litio tre e così via fino all’Uranio che ne ha novantadue. Nella Tavola Periodica, in realtà, troviamo anche una manciata di altri elementi con più di novantadue protoni, ma questi non esistono in natura: devono essere costruiti in grandi acceleratori di particelle e quasi tutti sopravvivono per meno di un istante. Per oggi … possiamo lasciarli perdere.
Cosa sono gli isotopi?
Dentro il nucleo si trovano anche i neutroni, che - come dice il loro nome - non posseggono alcuna carica elettrica, a differenza dei protoni carichi positivamente. Se due nuclei con lo stesso numero di protoni (quindi dello stesso elemento) hanno un differente numero di neutroni, si dicono isotopi. Il numero di neutroni in un nucleo ci dice esattamente di quale isotopo stiamo parlando. Chimicamente, gli isotopi di un certo atomo sono tutti uguali fra loro perché hanno lo stesso numero di protoni e di elettroni, che determinano le loro proprietà chimiche. Quello che cambia, è solo la massa del loro nucleo (un neutrone pesa appena un poco di più di un protone e la somma di protoni e neutroni ci dà la massa totale del nucleo).
Il nucleo dell’isotopo più comune dell’Idrogeno ha un solo protone e nessun neutrone. Lo chiamano tutti semplicemente Idrogeno ma il suo vero nome sarebbe Pròzio. Quando in un nucleo di Idrogeno c’è pure un neutrone, abbiamo il Deuterio. In natura, ogni 6670 atomi di Pròzio ne troviamo uno solo di Deuterio. E quando nel nucleo di Idrogeno ne troviamo due abbiamo il Trizio, che è instabile ed esiste solo in tracce, ma può essere prodotto artificialmente
L’idrogeno è l’unico atomo ad avere isotopi con nomi propri. Tutti gli isotopi degli altri atomi si distinguono solo per i numeri che vengono scritti in alto a sinistra rispetto al loro simbolo atomico. Ad esempio l’isotopo più stabile dell’Uranio è l’ 238U. Si tratta di un atomo di uranio (92 protoni) con massa totale di 238, cioè contenente anche 238-92=146 neutroni. Invece, l’ 235U ha sempre i suoi 92 protoni (se no non sarebbe Uranio!) ma ha “solo” 235-92=143 neutroni.
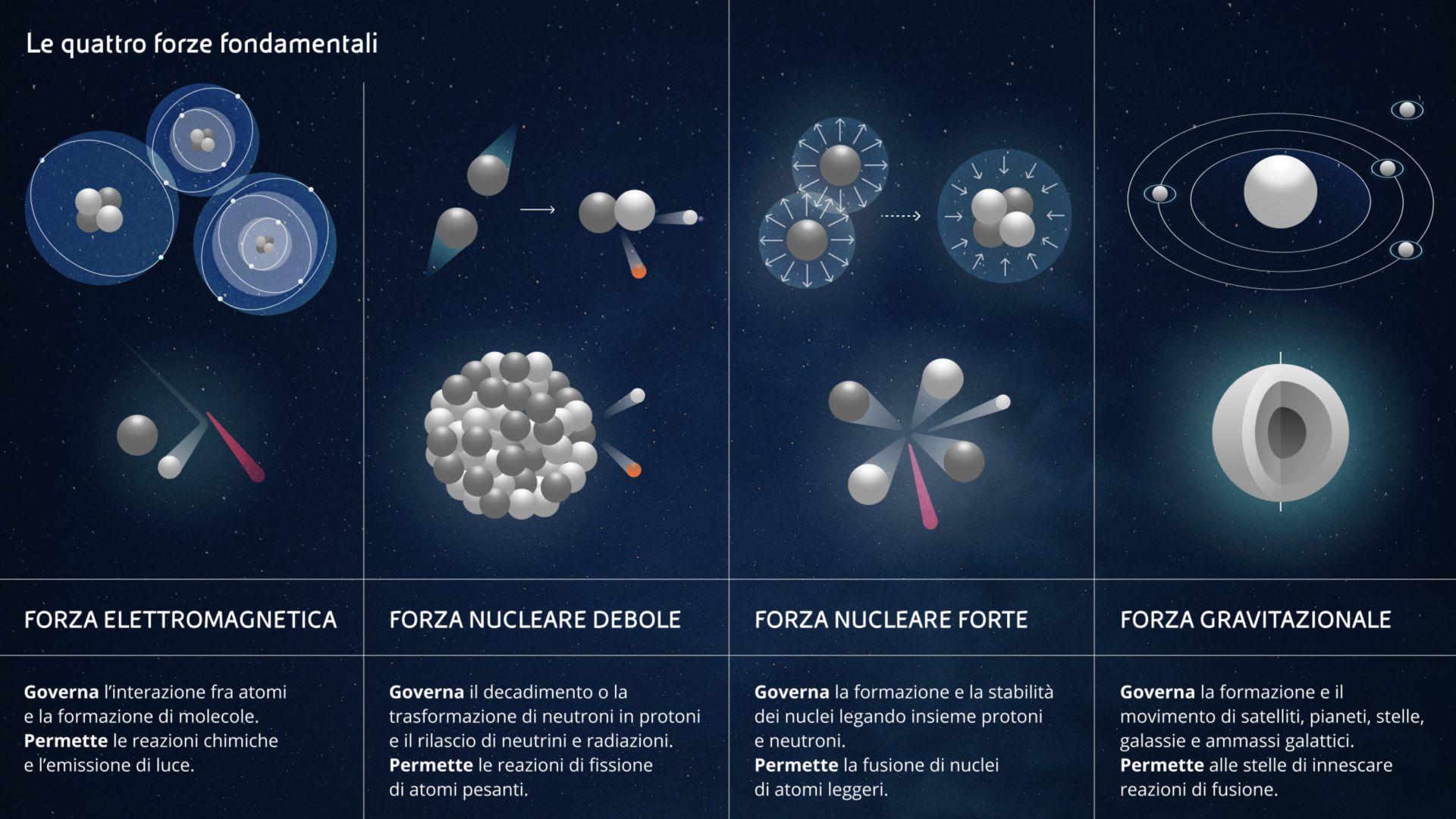
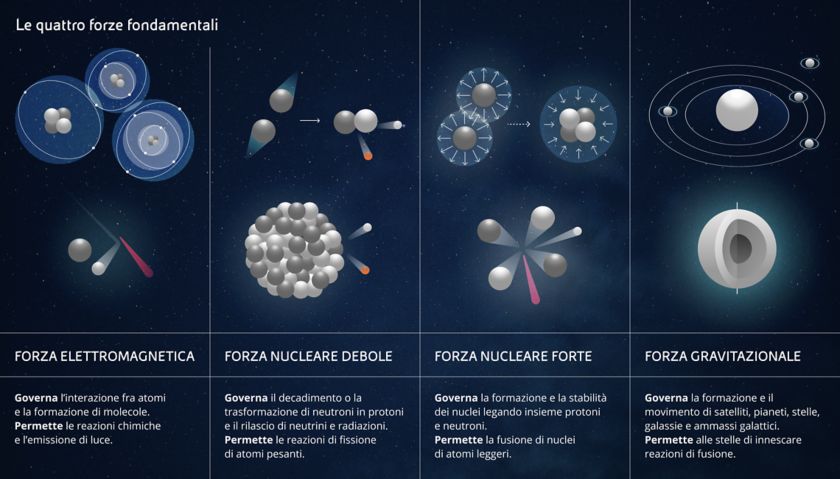
Questo è quasi tutto quello che ci serve sapere su come sono fatti i nuclei, se non stiamo pensando seriamente di prenderci una laurea in fisica nucleare. Ora ci rimane solo da capire quali forze agiscono dentro questi nuclei. Già che ci siamo, parleremo anche di tutte le forze che agiscono nell’Universo. Niente panico: in tutto sono solo quattro!
Come dicevamo, a quanto ne sappiamo oggi, tutte le forze dell’Universo possono essere ricondotte a quattro forze fondamentali.
- La forza elettromagnetica è quella che ci permette di leggere queste parole grazie all’elettricità che fa andare il vostro dispositivo, ma è anche quella che produce fotoni, cioè luce. La forza elettromagnetica a livello microscopico agisce fra singole particelle cariche. Ma quando tante particelle cariche lavorano tutte insieme si possono fare funzionare cose molto più grosse come i motori elettrici, e compiere reazioni chimiche. Forse non ci avete mai pensato ma, anche quando diamo un calcio a un pallone, gli elettroni che si trovano sulla superficie esterna della nostra scarpa respingono quelli che si trovano sulla superficie della palla. Anche una partita di calcio, in fondo, è un esperimento scientifico.
- La forza gravitazionale agisce su tutti i corpi dotati di massa. E’ la più debole di tutte ma è evidente anche a distanza elevata. E’ quella che fa cadere le mele in testa a Newton, che tiene insieme il Sistema Solare e le Galassie, ma è anche quella che crea una enorme pressione all’interno delle stelle. Questa pressione permette alle stelle stesse di innescare e sostenere la fusione dell’Idrogeno e le fa brillare per miliardi di anni.
Le ultime due forze sono un po’ meno visibili delle altre ma altrettanto… fondamentali:
- La forza nucleare debole e la forza nucleare forte. Dal nome si capisce subito che lavorano nel nucleo degli atomi. In particolare, la prima è responsabile della conversione di neutroni in protoni e elettroni, oltre che della radioattività, mentre la seconda serve a tenere i protoni e i neutroni di un nucleo legati fra di loro ed a permettere agli atomi di... esistere. E’ questa che, contrastando la repulsione elettrica fra particelle positive, evita che ogni protone del nucleo schizzi via da tutti gli altri protoni suoi coinquilini.
Quando si riesce a vincere la forza nucleare forte fra protoni e neutroni di atomi pesanti – i fisici definiscono pesanti tutti gli atomi con più protoni del Ferro, che ne ha 26 - si riesce a liberare un sacco di energia. Se ne riesce a liberare ancora di più se si fondono insieme atomi leggeri – cioè con meno protoni del Ferro - ma ne parleremo più avanti quando discuteremo di fissione e di fusione nucleare.
L'autore: Luca Longo
Chimico industriale specializzato in chimica teorica. È stato ricercatore per 30 anni prima di passare alla comunicazione scientifica di Eni.
Fusione a confinamento magnetico
Tutte le news e gli approfondimenti in testi, video e podcast originali per raccontare le sfide tecniche e gli sviluppi industriali di una tecnologia rivoluzionaria.

Eni.com è una piattaforma disegnata in modo digitalmente sostenibile che offre una visione immediata delle attività di Eni. Si rivolge a tutti, raccontando in modo trasparente e accessibile i valori, l’impegno e le prospettive di un’impresa tecnologica globale per la transizione energetica.
Scopri la nostra mission